Что такое водородный показатель и шкала кислотности?
 Для всех, кто занимается выращиванием растений на небольшом участке или в промышленных масштабах, на открытых участках или в тепличных хозяйствах, вопросы контроля кислотности почвы является очень важным. По ряду причин. Самым важным является то, что от уровня кислотности почвы напрямую зависит развитие корневой системы растения и ее способность усваивать питательные вещества. Кроме того, повышение кислотности негативно влияет на развитие полезной микрофлоры почвы, а также способствует накоплению тяжелых металлов в тканях растения. Для разных растений определены оптимальные значения кислотности почвы, однако для большинства растений эти значения лежат в диапазоне, близком к нейтральному.
Для всех, кто занимается выращиванием растений на небольшом участке или в промышленных масштабах, на открытых участках или в тепличных хозяйствах, вопросы контроля кислотности почвы является очень важным. По ряду причин. Самым важным является то, что от уровня кислотности почвы напрямую зависит развитие корневой системы растения и ее способность усваивать питательные вещества. Кроме того, повышение кислотности негативно влияет на развитие полезной микрофлоры почвы, а также способствует накоплению тяжелых металлов в тканях растения. Для разных растений определены оптимальные значения кислотности почвы, однако для большинства растений эти значения лежат в диапазоне, близком к нейтральному.
Для почвы различают актуальную (или активную) и потенциальную кислотность.
Актуальная кислотность определяется активностью ионов водорода в почвенном растворе и контролируется рН-метрами в единицах рН.
Потенциальная кислотность состоит в появлении дополнительных водородных ионов в растворе при взаимодействии почвы с удобрениями или другими химическими веществами. Иными словами, из-за наличия в твердой фазе почвы кислот и кислотных агентов, как в диссоциированных, так и в недиссоциированных состояниях, грунт может вести себя как слабая кислота. Различают обменную и гидролитическую потенциальную кислотность.
Так что же такое кислотность, и почему более кислая среда характеризуется меньшим значением рН? Впервые понятие водородный показатель рН ввел датский ученый С.П.Л. Серенсен в 1909 году для удобства представления активности водородных ионов в растворе. Активность – эффективная концентрация компонентов раствора с учетом возможных взаимодействий между ними. Водородный показатель рН является безразмерной величиной и численно равна отрицательному десятичному логарифму активности ионов водорода.
На практике для разведенных водных растворов активность ионов водорода Н+ (в водных растворах ионы гидроксония [H3O+] считают равной их молярной концентрации.
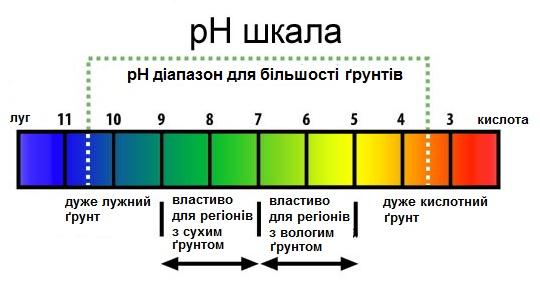 Нормальным считается среда, водородный показатель которого равен 7. Значение 7 для нейтральной среды выбрано не случайно, оно получено от численного значения ионного произведения воды при комнатной температуре 22 °С.
Нормальным считается среда, водородный показатель которого равен 7. Значение 7 для нейтральной среды выбрано не случайно, оно получено от численного значения ионного произведения воды при комнатной температуре 22 °С.
Для других температурных условий значение рН нейтральной среды может лежать в пределах от 7,48 до 6,13.
Растворы, рН которых больше 7 являются щелочными, а меньших 7 – кислотными (рис 2, [4]). Стоит помнить, что шкала рН является не арифметической, а логарифмической. Поэтому, когда говорят, что значение рН двух растворов отличается на 1, то это означает, что концентрация ионов водорода в одном из них в 10 раз больше.
Принципы измерения водородного показателя
Для определения рН существует два метода: колориметрический и потенциометрический. Колориметрический основывается на свойстве некоторых веществ, называемых индикаторами (например лакмус, фенолфталеин, метиловый оранжевый и др.), менять свой цвет в зависимости от рН исследуемого раствора. Капнув каплю исследуемого вещества на лакмусовую бумажку и сравнив ее цвет с таблицами, определяем рН. Однако этот метод является слишком оценочным и не пригодным для точных исследований.
Наиболее точной методикой определения рН является потенциометрическая, основы которой заложил Вальтер Нернст. В 1889 году он записал уравнение, показывающее прямую пропорциональную зависимость между электродвижущей силой и активностью ионов в растворе.
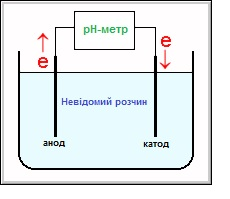 В общем случае, электродвижущая сила в электрохимической ячейке с двумя электродами, погруженными в раствор электролита (рис. 3 [8]), определяется как: Е = Ек – Еа, где Ек и Еа – потенциалы катода и анода соответственно, что, согласно уравнению Нернста, связаны с активностью ионов в растворе.
В общем случае, электродвижущая сила в электрохимической ячейке с двумя электродами, погруженными в раствор электролита (рис. 3 [8]), определяется как: Е = Ек – Еа, где Ек и Еа – потенциалы катода и анода соответственно, что, согласно уравнению Нернста, связаны с активностью ионов в растворе.
Для задачи определения рН уравнение Нернста приобретает вид: де Е - електродний потенціал, Е0 – стандартный электродный потенциал, R – універсальна газова стала, F – число Фарадея, Т – абсолютная температура, n – число электронов, участвующих в электродной реакции.
Таким образом, суть потенциометрического метода измерения водородного показателя сводится к измерению ЭДС системы, состоящей из индикаторного (измерительного) электрода и электрода сравнения. Потенциал индикаторного электрода зависит от активности ионов водорода в растворе, а потенциал электрода сравнения, в отношении которого измеряется потенциал индикаторного электрода, известный и неизменной.
Наиболее широкое применение получил индикаторный стеклянный электрод с водородной функцией, а как электрод сравнения – хлорсеребряный электрод. Рассмотрим их более подробно.
Устройство и принцип работы стеклянного электрода
Стеклянный электрод относится к ионоселективным, или мембранным электродам. Принцип действия такого электрода заключается в том, что тонкая мембрана (в данном случае стеклянная) разделяет две среды с разной активностью ионов водорода (исследуемый раствор и буферный раствор, которым заполнен электрод). В результате между двумя сторонами мембраны образуется разность потенциалов, которая и является измеряемой величиной.
(рис. 4 [9]). Стеклянный электрод это комплексная система: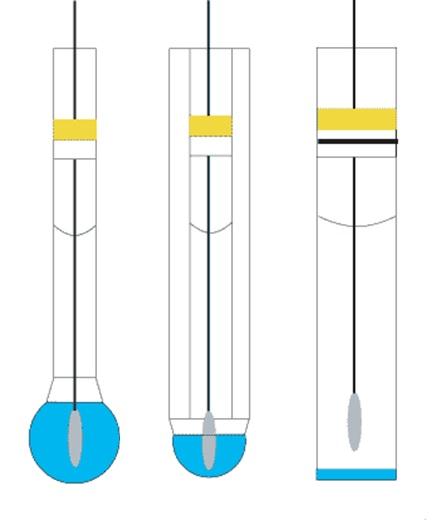
- корпус (может быть из стекла и пластика),
- тонкая мембрана, толщиной десятые километра. Изготавливается в виде сферы, конуса или плоскости, в зависимости от применения,
- внутри размещен контактный электрод (из серебра, платины), покрытый солью этого металла (чаще всего серебро с хлоридом серебра),
- который помещен в буферный раствор, как правило слабый раствор кислоты или соли.
Мембрана изготавливается из специальных сортов стекла, что характеризуется определенной электропроводностью. Такое стекло является проницаемым для ионов водорода Н+, и непроницаемым для других ионов (селективность мембраны). Электропроводность его обусловлена наличием ионов Na, К или Li, входящих в его состав в процессе синтеза. Существуют различные теории, объясняющие, каким образом возникает потенциал в стеклянном электроде.
Наибольшее экспериментальное подтверждение нашли основные положения ионообменной теории Б.П. Никольского. Согласно ей, во внешнем слое мембраны, граничащей с раствором, образуется тонкий гидратированный слой вследствие того, что катионы щелочных металлов из стекла могут переходить в раствор, а их место могут занимать другие катионы из раствора. Такие процессы происходят с обеих сторон мембраны, и со стороны исследуемого раствора, и со стороны буферного раствора в электроде. В кислых средах мембрана насыщается ионами водорода и стеклянный электрод приобретает свойства водородного электрода. В щелочных средах свободные места в кристаллической структуре стекла занимают катионы щелочного металла и электрод приобретает функции металлического электрода.
Стеклянные электроды могут быть различной конструкции. Например, для измерения рН твердых веществ (таких как кожа, бумага и т. д.) очень удобны электроды с плоской мембраной. Для вязких сред, измерения рН почвы, медицинских применений, в пищевой промышленности часто применяют электроды с конусной или заостренной поверхностью.
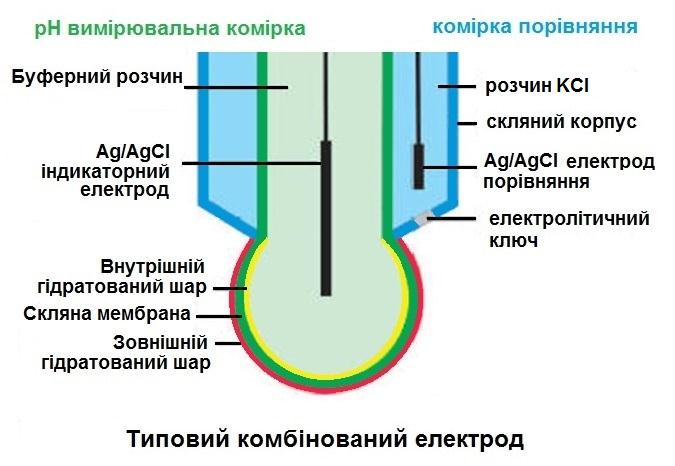
 Особую популярность получили комбинированные электроды (рис. электрод PF 47), сочетающие в себе функции индикаторного электрода и электрода сравнения (вспомогательного электрода). Конструктивно, это выглядит так, что стеклянный электрод помещается в еще одну дополнительную стеклянную (или пластиковую) колбу, в которой находится еще один контактный электрод (как правило серебряная проволока со слоем хлорида серебра) в буферном растворе (например хлорида калия) (рис 6 [11]).
Особую популярность получили комбинированные электроды (рис. электрод PF 47), сочетающие в себе функции индикаторного электрода и электрода сравнения (вспомогательного электрода). Конструктивно, это выглядит так, что стеклянный электрод помещается в еще одну дополнительную стеклянную (или пластиковую) колбу, в которой находится еще один контактный электрод (как правило серебряная проволока со слоем хлорида серебра) в буферном растворе (например хлорида калия) (рис 6 [11]).
Взаимодействие электрода сравнения с исследуемым раствором проходит через электролитический ключ, функция которого стабилизировать потенциал вспомогательного электрода. Раствор хлорида калия через пористую мембрану постоянно просачивается во внешней раствор.
Несомненными преимуществами стеклянного электрода является его стабильные характеристики, возможность работы в широком диапазоне значений рН и различных температурных режимах, они характеризуются высоким быстродействием, не поддаются окислению. Однако для обеспечения правильной работы, электроды нужно хранить в соответствующих буферных растворах, промывать дистиллированной водой после каждого использования и калибровать перед началом работы [14].
Цитируемая литература:
1. Васильев В. П. Аналитическая химия. В 2 кн. Кн. 2. Физико-химические методы анализа: Учеб. для студ. вузов, обучающихся по химико-технол. спец. - 2-е изд., перераб. и доп. - М.:Дрофа, 2002. - 384 с.
2. П. Эткинс. Физическая химия. Перевод с англ. К.П. Бутина. -Изд. «Мир», -Москва, 1980 г., -580 с.
3. Р. Бейтс. Определение рН. Теория и практика. Перевод с англ. Б.П. Никольского и М.М. Шульца. Изд. «Химия» Ленинградское отделение, - 1972 г, -380 с.
4.http://pozmir.ru/?attachment_id=7002
5. http://www.znaytovar.ru/new138.html
6. http://studopedia.net/9_94492_steklyanniy-elektrod-elektrodi-sravneniya-elektrometricheskoe-izmerenii-pH-sredi.html
8.http://sbio.uct.ac.za/structural-biology-coursework-modules/laboratory-techniques-structural-biologists/measuring-ph/
9. http://www.pathfinderinstruments.com/phelecperfrm.htm
10. http://www.flairform.com/hints/ph_meter_maintenance.htm
11. http://www.mbhes.com/improvements_in_ph_measurement.htm American Laboratory News February 2004, Dr. Franco, Mr. Finke Mr. Hail, Hanna Instruments, 584 Park East Dr., Woonsocket, RI 02895, U.S.A.
12. http://zipgomel.by/about2
13. http://openacc.ru/agrohimicheskie-metody/1823-elektrody-dlya-opredeleniya-rn.html
14. http://www.labprice.ua/statti/vse_o_rabote_s_rn-metrami






























































































